Пять элементов — естественный переход из одного состояния в другое
Для критически настроенного человека весьма интересными и полезными могут оказаться наблюдения за тем, как при переходе людей из одного состояния в другое меняются их физиологические характеристики. Например, поза и тон голоса могут меняться практически мгновенно. Наблюдая за другими, вы сможете многое открыть в самом себе, особенно если до сих пор вы считали, что лишены творческой энергии или что вам не хватает реализма, или что вы плохой организатор. Вы можете несколько модифицировать модель стратегии Диснея – например, у себя дома используйте различные комнаты или кресла для обозначения разных позиций. Но помните о необходимости соблюдения следующих важных правил НЛП:
Каждой позиции должен соответствовать некий осязаемый «якорь», такой, чтобы он неизменно ассоциировался у вас с определенным состоянием (так же, как любимое кресло ассоциируется у вас с отдыхом).
Прежде чем войти в какое‑то новое состояние, выйдите из предыдущего (поэтому целесообразно использовать для различных состояний и разные положения в пространстве). В противном случае существует опасность прихватить с собой элементы прежнего состояния при переходе в новое, «сесть на два стула сразу».
Как можно больше практикуйтесь (так же, как и при освоении любой другой техники) и будьте гибкими. Модель стратегии Диснея можно применять в самых различных случаях – и по отношению к людям, и по отношению к процессам, медленным или быстропротекающим.
Все это не более чем модели и приемы, на практике же вы вольны думать так, как считаете нужным, и менять точку зрения по своему усмотрению. Цель проведенного выше упражнения – помочь вам научиться в случае необходимости мгновенно переходить из одного состояния в другое (например, в случае внезапной опасности). Если вы сумеете представить себя входящим в какую‑то определенную комнату или сидящим в каком‑то определенном кресле, эти представления смогут вызвать у вас такие же ассоциации, как и реальные физические действия. Умение создавать для себя подобные подкрепляющие «якоря» является необходимым условием процесса обучения.
Моделируем себя самого
Ранее мы рассматривали моделирование как выявление стратегий деятельности людей, достигших совершенства в какой‑либо области, и воспроизведение этих стратегии в своей деятельности. Модель стратегии Диснея, однако, наглядно показывает, что мы можем основываться и на собственных воспоминаниях. Внутри любого из нас находятся мечтатель, реалист и критик, которые при определенных условиях могут действовать нам во благо. Таким образом, каждый из нас располагает внутренними ресурсами, необходимыми для повышения эффективности своей деятельности. Если вы когда‑нибудь имели сильную побудительную мотивацию, были уверены в себе, если вам казалось, что все зависит только от вас, если вы были изобретательными, настойчивыми и готовыми к осмысленному риску, тогда вам не нужно искать пример для подражания Просто перенесите одну из своих эффективных стратегий в новую сферу деятельности. Например, из области спорта – в профессиональную сферу. Успешность в работе перенесите домой, из частной жизни – в общественную, и наоборот. Научитесь оценивать достоинства эффективных стратегий вне зависимости от тех или иных конкретных обстоятельств.
Подобно рецепту миндального пирожного или правилам перехода через улицу, стратегии могут быть использованы всеми. Необходимым условием личной успешности является умение находить в наибольшей степени подходящие вам стратегии в своем личном опыте или в опыте других людей. И отбрасывать те стратегии, которые недостаточно эффективны для достижения стоящих перед вами в данный момент целей.
В умении использовать модели для изменения стратегий заключается суть так называемого ускоренного обучения. Мы можем существенно ускорить обычно довольно вялотекущий процесс обучения, применив собственные эффективные стратегии. Так же мы можем использовать опыт других. Хотя, конечно, при этом не приходится рассчитывать на то, чтобы сразу же достичь их уровня. Каждый из нас способен научиться пользоваться обеими половинами своего мозга, более эффективно использовать внутренние ресурсы и таким образом добиваться исключительных успехов.
Определение
Агрегатные состояния вещества (от латинского aggrego -- присоединяю, связываю) -- это состояния одного и того же вещества твердое, жидкое, газообразное.
При переходе из одного состояния в другое происходит скачкообразное изменение энергии, энтропии, плотности и других характеристик вещества.
Твердые и жидкие тела
Определение
Твердыми телами называются тела, отличающиеся постоянством формы и объема.
В них межмолекулярные расстояния малы и потенциальная энергия молекул сравнима с кинетической. Твёрдые тела делятся на два вида: на кристаллические и аморфные. В состоянии термодинамического равновесия пребывают лишь кристаллические тела. Аморфные же тела по сути представляют метастабильные состояния, которые по своему строению приближаются к неравновесным, медленно кристаллизующимся жидкостям. В аморфном теле идет очень медленный процесс кристаллизации, процесс постепенного перехода вещества в кристаллическую фазу. Отличие кристалла от аморфного твёрдого тела заключается прежде всего в анизотропии его свойств. Свойства кристаллического тела зависят от направления в пространстве. Различного рода процессы, такие как теплопроводность, электропроводность, свет, звук, распространяются в различных направлениях твёрдого тела по-разному. Аморфные же тела (стекло, смолы, пластмассы) изотpопны, как и жидкости. Отличие аморфных тел от жидкостей состоит только в том, что последние текучи, в них невозможны статические деформации сдвига.
Кристаллические тела обладают правильным молекулярным строением. Именно правильному строению кристалла обязана анизотропия его свойств. Правильное расположение атомов кристалла образует так называемую кристаллическую решётку. В различных направлениях расположение атомов в решётке различно, что и ведет к анизотропии. Атомы (или ионы, или целые молекулы) в кристаллической решётке совершают беспорядочное колебательное движение около средних положений, которые и рассматриваются как узлы кристаллической решётки. Чем больше температура, тем больше энергия колебаний, а следовательно, и средняя амплитуда колебаний. В зависимости от амплитуды колебаний находится размер кристалла. Рост амплитуды колебаний ведет к росту размеров тела. Так объясняется тепловое расширение твёрдых тел.
Определение
Жидкими называют тела, которые имеют определенный объем, но не имеют упругости формы.
Жидкости отличаются сильным межмолекулярным взаимодействием и малой сжимаемостью. Жидкость занимает промежуточное положение между твёрдым телом и газом. Жидкости, как и газы, изотpопны. Кроме того, жидкость обладает текучестью. В ней, как и в газах, отсутствуют касательные напряжения (напряжения на сдвиг) тел. Жидкости тяжелы, т.е. их удельные веса сравнимы с удельными весами твёрдых тел. Вблизи температур кристаллизации их теплоемкости и другие тепловые характеристики близки к соответствующим характеристикам твёрдых тел. В жидкостях наблюдается до известной степени правильное расположение атомов, но лишь в малых областях. Здесь атомы тоже совершают колебательное движение возле узлов квазикpисталлической ячейки, но в отличие от атомов твёрдого тела они время от времени перескакивают от одного узла к другому. В результате движение атомов будет весьма сложным: оно колебательное, но вместе с тем центр колебаний перемещается в пространстве.
Газ, испарение, конденсация и плавление
Определение
Газ -- такое состояние вещества, в котором расстояния между молекулами велики.
Силами взаимодействия между молекулами при невысоких давлениях можно пренебречь. Частицы газа заполняют весь объем, который предоставлен газу. Газы можно рассматривать как сильно перегретые или ненасыщенные пары. Особым видом газа является плазма -- это частично ли полностью ионизированный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы. Плазма представляет собой газ из заряженных частиц, которые взаимодействуют между собой с помощью электрических сил на большом расстоянии, но не имеют ближнего и дальнего расположения частиц.
Вещества могут переходить из одного агрегатного состояния в другое.
Определение
Испарение -- это процесс изменения агрегатного состояния вещества, при котором с поверхности жидкости или твердого тела вылетают молекулы, кинетическая энергия которых превышает потенциальную энергию взаимодействия молекул.
Испарение -- это фазовый переход. При испарении часть жидкости или твердого тела переходит в пар. Вещество в газообразном состоянии, находящееся в динамическом равновесии с жидкостью называется насыщенным паром. При этом изменение внутренней энергии тела:
\[\triangle \ U=\pm mr\ \left(1\right),\]
где m -- масса тела, r -- удельная теплота парообразования (Дж/кг).
Определение
Конденсация -- процесс, обратный парообразованию.
Расчет изменения внутренней энергии происходит по формуле (1).
Определение
Плавление -- процесс перехода вещества из твердого состояния в жидкое, процесс изменения агрегатного состояния вещества.
Когда вещество нагревают увеличивается его внутренняя энергия, следовательно, увеличивается скорость теплового движения молекул. В том случае, если достигнута температура плавления вещества, то кристаллическая решетка твердого тела начинает разрушаться. Связи между частицами разрушаются, возрастает энергия взаимодействия между частицами. Теплота, передаваемая телу, идет на увеличении внутренней энергии этого тела, и часть энергии идет на совершение работы по изменению объема тела при его плавлении. У большинства кристаллических тел объем увеличивается при плавлении, но есть исключения, например, лед, чугун. Аморфные тела не имеют определенной температуры плавления. Плавление является фазовым переходом, который сопровождается скачкообразным изменением теплоемкости при температуре плавления. Температура плавления зависит от вещества и она не изменяется в ходе процесса. При этом изменение внутренней энергии тела:
\[\triangle U=\pm m\lambda \left(2\right),\]
где $\lambda $ -- удельная теплота плавления (Дж/кг).
Процесс обратный плавлению - кристаллизация. Расчет изменения внутренней энергии происходит по формуле (2).
Изменение внутренней энергии каждого тела системы в случае нагревания или охлаждения можно рассчитать по формуле:
\[\triangle U=mc\triangle T\left(3\right),\]
где c - удельная теплоемкость вещества, Дж/(кгК), $\triangle T$- изменение температуры тела.
При изучении переходов веществ из одних агрегатных состояний в другие невозможно обойтись без так называемого уравнения теплового баланса , которое гласит: суммарное количество теплоты, которое выделяется в теплоизолированной системе, равно количеству теплоты (суммарному), которое в этой системе поглощается.
По своему смыслу, уравнение теплового баланса -- это закон сохранения энергии для процессов теплообмена в термоизолированных системах.
Пример 1
Задание: В теплоизолированном сосуде находятся вода и лед при температуре $t_i= 0^oС$. Масса воды ($m_{v\ })$ и льда ($m_{i\ })$ соответственно равны 0,5 кг и 60 гр. В воду впускается водяной пар массой $m_{p\ }=$10 гр. при температуре $t_p= 100^oС$. Какой станет температура воды в сосуде после установления теплового равновесия? Теплоемкость сосуда не учитывать.
Решение: Определим, какие процессы происходят в системе, какие агрегатные состояния вещества мы имели и какие получили.
Водяной пар конденсируется, отдавая тепло.
Это тепло идет на плавление льда и, возможно, нагрев имеющейся и полученной изо льда воды.
Проверим сначала, какое количество теплоты выделяется при конденсации имеющейся массы пара:
здесь из справочных материалов имеем $r=2,26 10^6\frac{Дж}{кг}$- удельная теплота парообразования (применима и для конденсации).
Для плавления льда необходимо тепла:
здесь из справочных материалов имеем $\lambda =3,3\cdot 10^5\frac{Дж}{кг}$- удельная теплота плавления льда.
Получаем, что пар отдает тепла больше, чем требуется, только для расплавления имеющегося льда, следовательно уравнение теплового баланса запишем в виде:
Теплота выделяется при конденсации пара массой $m_{p\ }$ и остывании воды, которая образуется из пара от температуры $T_p$ до искомой T. Теплота поглощается при плавлении льда массой $m_{i\ }$ и нагревании воды массой $m_v+m_i$ от температуры $T_i$до $T.\ $ Обозначим $T-T_i=\triangle T$, для разности $T_p-T$ получим:
Уравнение теплового баланса приобретет вид:
\ \ \[\triangle T=\frac{rm_{p\ }+cm_{p\ }100-лm_{i\ }}{c\left(m_v+m_i+m_{p\ }\right)}\left(1.6\right)\]
Проведем вычисления, учитывая, что теплоемкость воды табличная $c=4,2\cdot 10^3\frac{Дж}{кгК}$, $T_p=t_p+273=373K,$ $T_i=t_i+273=273K$:
$\triangle T=\frac{2,26\cdot 10^6\cdot 10^{-2}+4,2\cdot 10^3\cdot 10^{-2}10^2-6\cdot 10^{-2}\cdot 3,3\cdot 10^5}{4,2\cdot 10^3\cdot 5,7\cdot 10^{-1}}\approx 3\left(К\right)$тогда T=273+3=276 (K)
Ответ: Температура воды в сосуде после установления теплового равновесия станет равна 276 К.
Пример 2
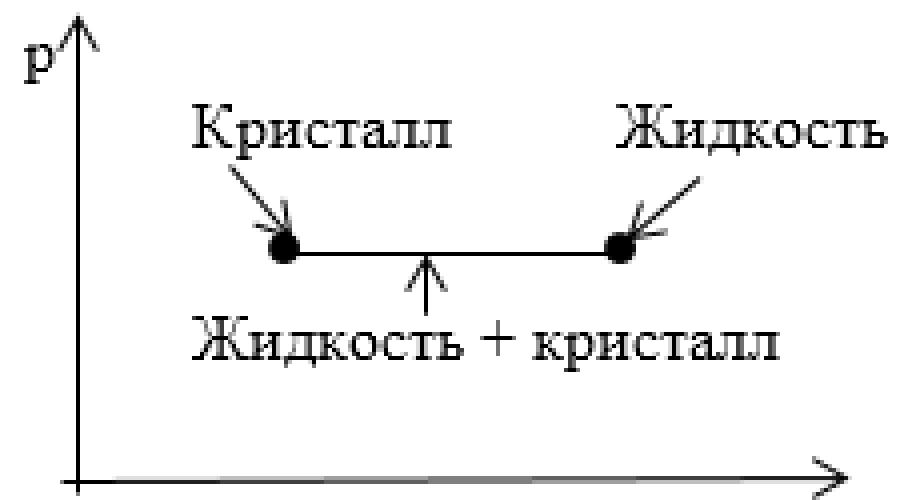
Задание: На рисунке показан участок изотермы, отвечающий переходу вещества из кристаллического в жидкое состояние. Что соответствует этому участку на диаграмме p,T?

Вся совокупность состояний, изображенных на диаграмме p,V горизонтальным отрезком прямой на диаграмме p,T изображается одной точкой, определяющей значения p и T, при которых осуществляется переход из одного агрегатного состояния в другое.
Агрегатные состояния веществ. Переход вещества из одного агрегатного состояния в другое.
Любое вещество состоит из молекул, а его физические свойства зависят от того, каким образом упорядочены молекулы и как они взаимодействуют между собой. В обычной жизни мы наблюдаем три агрегатных состояния вещества - твердое, жидкое и газообразное.В зависимости от температуры и давления (условий) большинство веществ может находиться в газообразном, жидком или твердом состояниях, называемых агрегатными состояниями вещества. Различие между тремя агрегатными состояниями определяется расстоянием между молекулами и степенью их взаимодействия.
| Агрегатное состояние вещества | Свойства вещества | Расстояние между частицами | Взаимодействие частиц | Характер движения | Порядок расположения |
| Газ | Не сохраняет форму и объем | Гораздо больше размеров самих частиц | Слабое | Хаотическое (беспорядочное) непрерывное. Свободно летают, иногда сталкиваясь. | Беспорядочное |
| Жидкость | Не сохраняет форму, сохраняет объем | Сравнимо с размерами самих частиц | Сильное | Колеблются около положения равновесия, постоянно перескакивая с одного места на другое. | Беспорядочное |
| Твердое тело | Сохраняет форму и объем | Мало по сравнению с размерами самих частиц | Очень сильное | Непрерывно колеблются около положения равновесия | В определенном порядке |
Процессов, в которых происходит изменение агрегатных состояний веществ, всего шесть. Переход вещества из твердого состояния в жидкое называется плавлением , обратный процесс – кристаллизацией . Когда вещество переходит из жидкости в газ, это называется парообразованием , из газа в жидкость – конденсацией . Переход из твердого состояния сразу в газ, минуя жидкое, называют сублимацией , обратный процесс – десублимацией .
· 1. Плавление
· 2. Кристаллизация
· 3. Парообразование
· 4. Конденсация
· 5. Сублимация
· 6. Десублимация
Примеры всех этих переходов мы с вами не раз наблюдали в жизни. Лед плавится, образуя воду, вода испаряется, образуя пар. В обратную сторону пар, конденсируясь, переходит снова в воду, а вода, замерзая, становится льдом. А если вы думаете, что вы не знаете процессов сублимации и десублимации, то не спешите с выводами. Запах любого твердого тела – это и есть не что иное, как сублимация. Часть молекул вырывается из тела, образуя газ, который мы и можем унюхать. А пример обратного процесса – это узоры на стеклах зимой, когда пар в воздухе, замерзая, оседает на стекле и образует причудливые узоры.
Водородная связь
Что такое водородная связь? Известный всем пример этой связи представляет обычная вода (H2O). Из-за того, что атом кислорода (О) более электроотрицателен, чем два атома водорода (Н), он как бы оттягивает от атомов водорода связывающие электроны. В результате создания такой ковалентной полярной связиобразуется диполь. Кислородный атом приобретает не очень большой заряд отрицательный, а водородные атомы – небольшой положительный заряд, который притягивается к электронам (их неподеленной паре) на кислородном атоме соседней молекулы Н2О (то есть воды). Таким образом, можно сказать, что водородная связь – это образующаяся сила притяжения между водородным атомом и электроотрицательным атомом. Важной особенностью водородного атома является то, что при притяжении его связующих электронов оголяется его ядро (то есть протон, другими электронами не экранированный). И хотя водородная связь более слабее, чем ковалентная, именно она обуславливает целых ряд аномальный свойств Н2О (воды).
Чаще всего эта связь образуется с участием атомов следующих элементов: кислород (О), азот (N) и фтор (F). Это происходит по той причине, что атомы данных элементов имеют малые размеры и характеризуются высокой электроотрицательностью. С атомами размера большего (сера S или хлор Cl) образующаяся водородная связь слабее, несмотря на то, что по своей электроотрицательности эти элементы сравнимы с N (то есть с азотом).
Существует два типа водородной связи:
1.Водородная межмолекулярная связь – появляется между двумя молекулами, например: метанол, аммиак, фтороводород
2. Водородная связь внутримолекулярная – появляется внутри одной молекулы, например: 2-нитрофенол.
Также в настоящее время есть мнение, что водородная химическая связь бывает слабой и сильной. Они отличаются друг от друга по энергии и длине связи (расстояние между атомами):
1. Водородные связи слабые. Энергия – 10-30 кДж/моль, длина связи – 30. Все вещества, перечисленные выше, являются примерами нормальной или слабой водородной связи.
2. Водородные связи сильные. Энергия – 400 кДж/моль, длина – 23-24. Данные, полученные экспериментальным путем, свидетельствуют о том, что сильные связи образуются в следующих ионах: ион-водороддифторид -, ион-гидратированный гидроксид -, ион оксония гидратированный +, а также в различных других органических и неорганических соединениях.
Для критически настроенного человека весьма интересными и полезными могут оказаться наблюдения за тем, как при переходе людей из одного состояния в другое меняются их физиологические характеристики. Например, поза и тон голоса могут меняться практически мгновенно. Наблюдая за другими, вы сможете многое открыть в самом себе, особенно если до сих пор вы считали, что лишены творческой энергии или что вам не хватает реализма, или что вы плохой организатор. Вы можете несколько модифицировать модель стратегии Диснея – например, у себя дома используйте различные комнаты или кресла для обозначения разных позиций. Но помните о необходимости соблюдения следующих важных правил НЛП:
Каждой позиции должен соответствовать некий осязаемый «якорь», такой, чтобы он неизменно ассоциировался у вас с определенным состоянием (так же, как любимое кресло ассоциируется у вас с отдыхом).
Прежде чем войти в какое-то новое состояние, выйдите из предыдущего (поэтому целесообразно использовать для различных состояний и разные положения в пространстве). В противном случае существует опасность прихватить с собой элементы прежнего состояния при переходе в новое, «сесть на два стула сразу».
Как можно больше практикуйтесь (так же, как и при освоении любой другой техники) и будьте гибкими. Модель стратегии Диснея можно применять в самых различных случаях – и по отношению к людям, и по отношению к процессам, медленным или быстропротекающим.
Все это не более чем модели и приемы, на практике же вы вольны думать так, как считаете нужным, и менять точку зрения по своему усмотрению. Цель проведенного выше упражнения – помочь вам научиться в случае необходимости мгновенно переходить из одного состояния в другое (например, в случае внезапной опасности). Если вы сумеете представить себя входящим в какую-то определенную комнату или сидящим в каком-то определенном кресле, эти представления смогут вызвать у вас такие же ассоциации, как и реальные физические действия. Умение создавать для себя подобные подкрепляющие «якоря» является необходимым условием процесса обучения.
Моделируем себя самого
Ранее мы рассматривали моделирование как выявление стратегий деятельности людей, достигших совершенства в какой-либо области, и воспроизведение этих стратегии в своей деятельности. Модель стратегии Диснея, однако, наглядно показывает, что мы можем основываться и на собственных воспоминаниях. Внутри любого из нас находятся мечтатель, реалист и критик, которые при определенных условиях могут действовать нам во благо. Таким образом, каждый из нас располагает внутренними ресурсами, необходимыми для повышения эффективности своей деятельности. Если вы когда-нибудь имели сильную побудительную мотивацию, были уверены в себе, если вам казалось, что все зависит только от вас, если вы были изобретательными, настойчивыми и готовыми к осмысленному риску, тогда вам не нужно искать пример для подражания Просто перенесите одну из своих эффективных стратегий в новую сферу деятельности. Например, из области спорта – в профессиональную сферу. Успешность в работе перенесите домой, из частной жизни – в общественную, и наоборот. Научитесь оценивать достоинства эффективных стратегий вне зависимости от тех или иных конкретных обстоятельств.
Подобно рецепту миндального пирожного или правилам перехода через улицу, стратегии могут быть использованы всеми. Необходимым условием личной успешности является умение находить в наибольшей степени подходящие вам стратегии в своем личном опыте или в опыте других людей. И отбрасывать те стратегии, которые недостаточно эффективны для достижения стоящих перед вами в данный момент целей.
В умении использовать модели для изменения стратегий заключается суть так называемого ускоренного обучения. Мы можем существенно ускорить обычно довольно вялотекущий процесс обучения, применив собственные эффективные стратегии. Так же мы можем использовать опыт других. Хотя, конечно, при этом не приходится рассчитывать на то, чтобы сразу же достичь их уровня. Каждый из нас способен научиться пользоваться обеими половинами своего мозга, более эффективно использовать внутренние ресурсы и таким образом добиваться исключительных успехов.
Часть пятая
Творческий подход к решению проблем
Глава 13
Использование для мышления обоих полушарий головного мозга
Стадии процесса мышления
Рассмотрение стадий мышления может оказаться весьма полезным. Эти стадии не обязательно должны быть строго последовательными, но нам важно знать, каким образом действуют различные «операционные» системы головного мозга и каким образом индивидуальный процесс мышления соотносится с универсальными мыслительными стратегиями.
Подготовка
Стадия подготовки соответствует этапу планирования какого-либо проекта и включает в себя определение проблемы, сбор данных и принятие основных допущений. Эта стратегия во многом сходна с первой стадией четырехзвенной циклической модели успеха, рассмотренной нами в части первой, на которой вы решаете, что, собственно, вам нужно и какова ваша цель. На этом этапе следует сформулировать вашу цель в письменном виде, а затем использовать технику визуализации для того, чтобы как можно более полно ощутить желаемый результат и отразить его в формулировке цели.
Мы уже говорили о том, насколько важно иметь четкое представление о желаемом результате в процессе общения. То же самое справедливо и в отношении процесса решения проблем. Задайте сами себе вопрос: «Чего именно я хотел бы добиться?» Суть «проблемы» общения, так же как и любой другой, заключается в преодолении разрыва между вашим нынешним и желаемым состоянием (при помощи обмена информацией, убеждения, получения ответов на вопросы и т. п.)
Анализ
На этой стадии следует заглянуть в глубь проблемы, учесть все плюсы, взвесить все «за» и «против» К сожалению, довольно часто решение проблемы сводят к анализу ее частей и работе над ними. Анализ определенных сторон вопроса в ущерб целостному представлению связан с деятельностью левого полушария головного мозга. Этот процесс носит линейный характер, логическая схема выглядит примерно следующим образом «Если А, то Б».
К несчастью, чем дальше вы продвигаетесь по этому пути, тем труднее вам становится признать правомочность какого-либо иного, не линейного типа мышления. Преимущество линейного типа мышления состоит в том, что на его основе можно создавать алгоритмы, используемые при разработке разного рода методов и систем. Недостаток же этого типа мышления состоит в том, что с его помощью невозможно решить такие проблемы, перед которыми бессильны различные логически выстроенные «системы» и компьютерные программы. Такие проблемы слишком сложны и во многом зависят от «человеческого» фактора.
Агрегатные состояния вещества (от лат. aggrego — присоединяю) — это состояния одного и того же вещества в различных интервалах (промежутках) температур и давлений .
Агрегатными состояниями принято считать газообразное , жидкое и твердое . Самыми простыми примерами существования одного и того же вещества в этих трех агре-гатных состояниях, которые наблюдаются в повседневной жизни, являются лед, вода и водяной пар . Невидимый водяной пар всегда присутствует и в окружающем нас воздухе. Вода существует в интервале температур от 0 °С до 100 °С, лед — при температуре ниже 0 °С. При температуре выше 100 ºС и нормальном атмосферном давлении молекулы воды существуют только в газообразном состоянии — в виде водяного пара. Вода, лед и водяной пар — это одно и то же вещество с химической формулой Н 2 О .
Многие вещества в обыденной жизни мы наблюдаем только в одном из агрегатных состояний. Так, кислород в окружающем нас воздухе представляет собой газ. Но при температуре -193°С он превращается в жидкость. Охладив эту жидкость до -219 ºС, мы получим твердый кислород. И на-оборот, железо в обычных условиях твердое. Однако при температуре 1535 °С железо плавится и пре-вращается в жидкость. Над расплавленным железом будет находиться газ — пар из атомов железа.
Различные агрегатные состояния существуют у каждого вещества. Отличаются эти вещества не молекулами, а тем, как эти молекулы расположены и как движутся. Расположение молекул воды в трех агрегатных состояниях показано на рисунке:
Переход из одного агрегатного состояния в другое. При определенных условиях вещества могут переходить из одного агрегатного состояния в другое. Все возможные при этом превращения отображены на рисунке:

Всего различают шесть процессов, при которых происходят агрегатные превращения вещества . Переход вещества из твердого (кристаллического) состояния в жидкое называется плавле-нием кристаллизацией , или отвердеванием . Пример плавле-ния — таяние льда, обратный процесс происходит при замерзании воды.
Переход вещества из жидкого состояния в газообразное называется парообразованием , обратный процесс называется конденсацией . Пример парообразования — испарение воды, обратный процесс можно наблюдать при выпадении росы.
Переход вещества из твердого состояния сразу в газообразное (минуя жидкое) называется сублимацией , или возгонкой , обратный процесс называется десублимацией . Например, графит можно нагреть до тысячи, двух тысяч и даже трех тысяч градусов и, тем не менее, в жидкость он не превратится: он будет сублимироваться, т. е. из твердого состояния сразу переходить в газообразное. Непосредственно в газообразное состояние (минуя жидкое) переходит и так называемый сухой лед (твердый оксид углерода СО 2 ), который можно увидеть в контейнерах для транспортировки мороженого. Все запахи, которыми обладают твердые тела (например, нафталин), также обусловлены возгонкой: вылетая из твердого тела, молекулы образуют над ним газ (или пар), обладающий запахом.
Примером десублимации является образование на окнах зимой узоров из кристалликов льда. Эти красивые узоры образуются при десублимации водяного пара, находящегося в воздухе.
Переходы вещества из одного агрегатного состояния в другое играют важную роль не только в природе, но и в технике. Так, воду, превращенную в пар, можно использовать а паровых турбинах на электростанциях. Из расплавленных металлов на заводах получают различные сплавы: сталь, чугун, латунь и т. д. Для понимания этих процессов надо знать, что происходит с вещест-вом при изменении его агрегатного состояния и при каких условиях это изменение возможно.